JDDW 2019では、「人を対象とする医学系研究に関する倫理指針」に基づいたJDDW統一の倫理指針を実施いたします。
演題応募時には、下記の手順にて手続きをお願いいたします。
- Ⅰ.「1. 日本消化器関連学会週間(Japan Digestive Disease Week : JDDW)人を対象とする医学系研究に関する倫理指針(JDDWでの発表、抄録作成において遵守すべきこと)」をお読みください。
- Ⅱ.ご自身の発表内容が「2.JDDW演題登録時Medical ethics申請」でどの項目に該当するかをご選択ください(演題応募画面にも同じチェック項目がありますので、その中からご選択ください)。
- Ⅲ.ご自身の発表内容がどのような審査を必要とするかについては「3.JDDW発表における倫理指針(カテゴリー分類)」のフローチャートに沿って確認のうえ、手続きをお願いいたします。
- Ⅳ.その他、不明な点については「4.よくあるご質問(Q&A)」をご確認ください。
JDDW医学系指針・臨床研究法啓発ビデオについて
JDDWでは、臨床研究法施行に伴い、臨床研究を実施するために必要な規制、学会発表や論文投稿において遵守すべき事項についてのビデオを作成いたしました。よろしければご参考ください。
1.JDDW 倫理指針
JDDWの倫理指針は下記よりダウンロードください。
日本消化器関連学会週間(Japan Digestive Disease Week : JDDW)人を対象とする医学系研究に関する倫理指針(JDDWでの発表、抄録作成において遵守すべきこと)
<参考:厚生労働省,文部科学省 平成29年5月29日一部改訂>
「人を対象とする医学系研究に関する倫理指針」
2.JDDW 演題登録時 Medical ethics 申請
演題応募の際には、倫理審査が必要な発表かどうかの申告をしていただきます。下記の申請画面から該当する項目をひとつ選び、申請の上、ご応募いただきますようお願いいたします。
なお、応募時に分かる用フローチャートも用意いたしましたので、チャートに沿って、ご自身の発表がどのような審査を必要とするか、確認をお願いいたします。詳細は「3.JDDW 発表における倫理指針(カテゴリー分類)」の「フローチャート」をご参照ください。
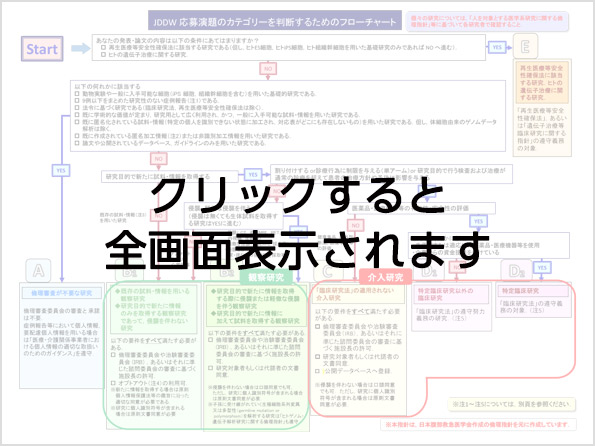
3.JDDW 発表における倫理指針(カテゴリー分類)
演題応募時には下記のフローチャートに沿って、ご自身の発表がどのような審査を必要とするか、確認の上、手続きをお願いいたします。
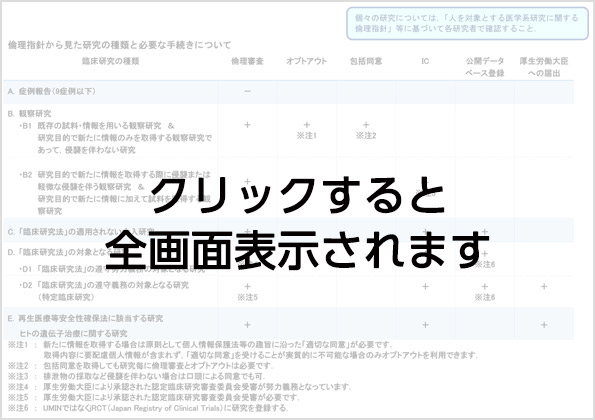
カテゴリー分類・倫理指針から見た研究の種類と必要な手続きにつきましても合わせてご確認ください。
倫理指針から見た研究の種類と必要な手続き
- A. 症例報告など倫理審査が不要な研究
-
- 動物実験や一般に入手可能な細胞(iPS 細胞,組織幹細胞を含む)を用いた基礎的研究.
- 9例以下をまとめた研究性のない症例報告.
- 法令に基づく研究(臨床研究法,再生医療等安全性確保法は除く).
- 既に学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報を用いた研究.
- 既に匿名化されている試料・情報(特定の個人を識別できない状態に加工され,対応表がどこにも存在しないもの)を用いた研究.
但し,体細胞由来のゲノムデータ解析は除く. - 既に作成されている匿名加工情報または非識別加工情報を用いた研究.
- 論文や公開されているデータベース,ガイドラインのみを用いた研究.
- B. 観察研究
-
B1. - 既存の試料・情報を用いる観察研究.
- 研究目的で新たに情報のみを取得する観察研究であって,侵襲を伴わない研究
B2. - 研究目的で新たに情報を取得する際に侵襲または軽微な侵襲を伴う観察研究.
- 研究目的で新たに情報に加えて試料を取得する観察研究.
- C. 「臨床研究法」の適用されない介入研究
- 体外診断薬を用いた介入研究,医療手技や手術方法の評価を行う研究が含まれる.
- D. 「臨床研究法」の対象となる研究
-
D1. 「臨床研究法」の遵守努力義務の対象となる研究.
既承認の医薬品・医療機器等を用いてそれらの有効性・安全性を評価する介入研究で,関連する企業から資金提供が無い研究が該当する.D2. 「臨床研究法」の遵守義務の対象となる研究.
未承認・適応外の医薬品・医療機器等を用いる研究,または企業から資金提供を受ける介入研究(特定臨床研究)が該当する. - E. 再生医療等安全性確保法に該当する研究.ヒトの遺伝子治療に関する研究
- 厚生労働大臣の許可を要する.
- 臨床倫理審査
- 倫理審査委員会や施設内審査委員会 (IRB),あるいはそれに準じた諮問委員会に基づく施設長の許可.
観察研究の場合には各諮問委員会の審査に基づく施設長の許可. - オプトアウト
- 当該研究について情報を研究対象者等に直接通知するか,または当該施設の掲示板やホームページ上で公開し,研究対象者等が研究への参加を拒否する機会を保障すること.
同時に拒否の意思表示を受け付ける窓口(連絡先)を明示する必要がある. - 包括同意
- 診療情報・人体由来の試料取得時に,利用が明示されている当該研究以外の研究への利用についても文書で同意が与えられていること.
診療の一環として得られる情報・人体由来の試料について,具体的な研究内容を明示せずに将来の研究への利用について文書で同意が与えられていること.但し,それらの試料を用いて実際に研究を行うに際しては,改めて倫理審査委員会の審査に基づく施設長の許可と研究対象者へのオプトアウトが必要.
4.よくあるご質問(Q&A)
- Q 1
- オプトアウト(情報の公開と研究対象者の拒否権の保障)とはどんなものを指しますか?
- A 1
- その研究の概要を実施医療機関等の掲示板やホームページなどに公開して,研究対象者が自身の試料もしくは情報をその研究に利用されることを拒否する機会を保障することを指します.オプトアウト文書には下記の項目を記載することが求められています.
① 試料・情報の利用目的及び利用方法(他の機関へ提供される場合はその方法を含む.) ② 利用又は提供する試料・情報の項目 ③ 利用する者の範囲 ④ 試料・情報の管理について責任を有する者の氏名又は名称 ⑤ 研究対象者又はその代理人の求めに応じて,研究対象者が識別される試料・情報の利用又は他の研究機関への提供を停止すること ⑥ ⑤の研究対象者又はその代理人の求めを受け付ける方法
- Q 2
- オプトアウトの開示はいつまで行う必要性がありますか?
- A 2
- 研究開始前に開示し,拒否の機会を保障する必要があります.研究終了時までご提示いただく必要があります.
- Q 3
- 当院には倫理審査委員会がありません.学会発表はできませんか?
- A 3
- 以下の何れかに該当する研究は倫理審査委員会の審査を受けることなく発表は可能です.
上記以外は,必ず倫理審査委員会の審査を受け施設の長の許可が必要です.委員会を常設していない施設からの研究発表については,他施設からの倫理審査を受け付けている委員会で審査を受けて下さい.多施設共同研究の場合は,所属する施設の施設長の許可があれば,代表施設の倫理審査委員会での一括審査が可能な場合もあります.その場合は,所属施設での個別審査は必ずしも必要ありません.① 動物実験や一般に入手可能な細胞(iPS 細胞,組織幹細胞を含む)を用いた基礎的研究である. ② 9例以下をまとめた症例報告(但し,症例数に関係なく診療の有効性・安全性を評価するなど研究性のあるものは除く)である. ③ 法令に基づく研究である(臨床研究法,再生医療等安全性確保法は除く). ④ 既に学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報を用いた研究である. ⑤ 既に匿名化されている試料・情報(特定の個人を識別できない状態に加工され,対応表がどこにも存在しないもの)を用いた研究である.但し,体細胞由来のゲノムデータ解析は除く. ⑥ 既に作成されている匿名加工情報※又は非識別加工情報(※認定事業者等によって一定のルールの下で加工された情報)を用いた研究である. ⑦ 論文や公開されているデータベース,ガイドラインのみを用いた研究である.
- Q 4
- 包括同意とはどんな同意を指しますか?
- A 4
- 診療の一環として取得された情報や検体(試料)余剰分を,将来実施される様々な研究に利用させていただくことを文書で同意いただくものを指します.t,研究を行うに際して,改めて倫理審査委員会の審査に基づく施設長の許可と研究対象者へのオプトアウトが必要です.
注) 試料を用いてゲノム解析を行う場合は,同意を受ける際にゲノム解析を行う旨に関する事項の同意を受けていることが原則必要です.
- Q 5
- JDDWでは臨床研究の倫理審査は行ってもらえるのでしょうか?
- A 5
- JDDWでは,臨床研究の倫理審査は行っておりません.
JDDWの演題応募に際しては,倫理審査が不要な発表以外は,必ず関連の大学病院・関連学会(学会に研究倫理審査機能がある場合)・医師会等の倫理審査制度を利用し承認を得たうえで演題登録を行って下さい.
なお,消化器内視鏡学会及び消化器がん検診学会では,条件により倫理審査の受託を行っています.詳細は各学会事務局に直接お問い合わせください.
- Q 6
- 各施設の規程等とJDDWの指針が同一でない場合,どちらの内容を優先したらよいでしょうか?
- A 6
- JDDWにおける発表に際しては,JDDWの指針に従っていただく必要があります.但し,研究の遂行に関しては各施設の規程等に従ってください.最終的な発表内容に関しては,発表者個人とその施設の長が負うものとなります.
- Q 7
- 所属施設長とは部長の認可でよいですか?
- A 7
- 大学病院などであれば学長もしくは規定により権限を委任された,病院長,センター長,学科長,学類長などであり,その他の医療施設であれば所属する法人の長であるセンター長,施設長,組合長,病院長などに該当するため,規定により権限を委任されていない所属部署の部長の認可では無効となります.
- Q 8
- 9例以下をまとめた介入を伴わない症例報告は倫理審査委員会の審査が必要ですか?
- A 8
- 10例以上をまとめた症例報告は症例集積研究とみなされ倫理審査委員会の審査が必要です.但し,9例以下であっても治療例と非治療例の比較を行ったり,診療の有効性・安全性の評価を行ったり研究性のあるものは少数例でも倫理審査委員会の審査が必要となります.
- Q 9
- 自施設のC型慢性肝炎に対する以前のインターフェロン併用抗ウイルス療法施行例と新たな非併用の直接作用型抗ウイルス剤(DAA)施行例で,ウイルス学的著効達成(SVR)率や肝癌発生率など,短期および長期成績を学会発表したい場合には倫理審査委員会の審査は必要ですか?
- A 9
- 研究対象者の予後を含んだ各種臨床データを利用した研究は,各施設の倫理審査委員会あるいはそれに準じた諮問委員会での審査と,それに基づく施設長の許可を得るとともに,研究対象者あるいはその代諾者の同意(インフォームド・コンセント:IC) を得る必要があります.但し,過去の症例にさかのぼってあらためてICを得ることが実質的に不可能な場合は,オプトアウトを利用し,研究への参加が拒否できる機会を保障することでICに変えることが可能です.
- Q 10
- 関連施設10病院の初発肝細胞癌に対するラジオ波焼灼療法(RFA),肝動脈化学塞栓術(TACE),肝切除それぞれの短期および長期治療成績を集積してJDDWでの発表をしたい場合には倫理審査委員会の審査は必要ですか?
- A 10
- 研究の実施体制により対応が異なります.
1) 関連施設を共同研究機関とする場合(共同演者,共著者になります)
各施設に研究責任者を置き,個々の施設での倫理審査が必要です.倫理審査は,代表施設の倫理審査委員会での一括審査が可能な場合もあります.2) 関連施設を試料・情報の提供のみを行う機関(研究協力機関)とする場合(共同演者,共著者になりません)
関連施設の倫理審査は不要で,提供元の施設の長が把握していれば情報を取得することは可能です.但し,研究実施機関の研究責任者は,提供元の施設が適正に試料・情報を提供するために必要な体制及び規程の整備が行われていることを確認する必要があります(提供先の施設の体制によっては,研究に関しての通知・公開が必要な場合もあります).※匿名化が困難な情報が含まれる場合は倫理審査が必要となります.
- Q 11
- 採血は侵襲に当たりますか?
- A 11
- 診療で採血した検体の余剰分を用いる場合は,「侵襲なし」としてよい.
診療として行う採血の際に,研究目的で上乗せして採血量を増やす場合や,研究目的のみで採血をする場合であっても,一般健康診断で行われる程度の採血であれば,「軽微な侵襲」と判断してよい.
但し,前者の場合であって,明らかに研究対象者の身体に影響があると考えられる採血量の増加を伴うものや,後者の場合であって,一般健康診断で行われる採血量を超えるものに関しては,「侵襲あり」と判断される.
- Q 12
- 大腸癌再発症例における現在未承認薬の抗 PDL-1(programmed cell death ligand-1)抗体薬を使用した症例をまとめて報告したいのですが倫理審査会の承認は必要ですか?
- A 12
-
薬剤の適応外使用や未承認薬を使用する場合には以下のとおりです.
1) 研究目的ではなく,自由診療や高難度医療等,施設の規定に則り施設長の許可を得て行った症例を,後ろ向きにまとめる場合は「観察研究」として,倫理審査委員会の承認を得て下さい.但し,研究性のない9例以下の症例報告として発表する場合は倫理審査委員会の審査は不要です. 2) 研究としてこの治療を実施する場合は,「特定臨床研究」に該当し「臨床研究法」の対象となります.法に基づいた手続きを経てから実施して下さい.
- Q 13
- 先進医療で実施した胃癌手術におけるロボット手術の短期および長期成績をまとめて報告したいのですが,倫理審査委員会の審査と承認は必要ですか?
- A 13
- 先進医療は倫理審査委員会で既に承認されている筈です.承認された計画書記載の項目以外の評価を行う観察研究であれば,新たに研究計画書を作成し倫理審査委員会の承認を得る必要があります.
- Q 14
- 内視鏡の治療手技に関するビデオの発表をしたいのですが,同意は必要ですか?
- A 14
- 症例報告に該当し倫理指針の適用外ですが,「医療・介護関係事業者における個人情報の適切な取扱いのためのガイダンス(平成29年4月14日,個人情報保護委員会,厚生労働省)」を遵守し,個人情報の保護に配慮する必要があります.個人を特定することができないような配慮(名前やIDの削除,顔や個人の特徴が映らないようにするなど)がなされている場合は,文書同意は必須ではありません.
ただ,プライバシー等の観点からも可能であれば,文書にて同意を得ているとより良いと考えます.
またこの場合,包括同意を得たもので代用できます.包括同意とは診療情報や診療の一環として採取された検体(試料)を,将来にわたって様々な研究に利用させていただくことを書面で予め同意いただくものを指します.
- Q 15
- 患者の試写体(顔写真)などを発表で使用したいのですが,事後で同意を得る必要がありますか?
- A 15
- 症例報告に該当し倫理指針の適用外ですが,「医療・介護関係事業者における個人情報の適切な取扱いのためのガイダンス(平成29年4月14日,個人情報保護委員会,厚生労働省)を遵守し,個人情報の保護に配慮する必要があります.本ガイダンスでは,「特定の症例や事例を学会で発表したり,学会誌で報告したりする場合等は,氏名,生年月日,住所,個人識別符号等を消去することで匿名化されると考えられるが,症例や事例により十分な匿名化が困難な場合は,本人の同意を得なければならない」と記載されています.
- Q 16
- 続報のような発表に関しては,再度倫理審査を受ける必要性がありますか?
- A 16
- 研究計画書に記載された内容の範囲であれば再審査の必要はありません.
- Q 17
- 患者の癌組織を利用して,新たに発見された癌関連遺伝子群の発現を検証した発表を行いたいのですが,倫理審査委員会の審査は必要ですか?
- A 17
- 倫理審査委員会あるいはそれに準じた諮問委員会の審査に基づく施設長の許可が必要です.また同意取得(インフォームド・コンセント:IC)またはオプトアウトも必要です.
- Q 18
- 公開されているデータベース,ガイドラインなどをまとめた研究発表,あるいは法令に基づく研究発表は倫理審査委員会での審査を受ける必要がありますか?
- A 18
- 公開されているデータベース,ガイドラインには個人情報は含まれませんので審査を受ける必要はありません(但し引用したデータベース・ガイドラインは明記する必要があります).但し,公開されているデータベースであっても個人情報に再連結するようなことを行う研究に関しては倫理審査委員会の審査が必要になります.臨床研究法,再生医療等安全性確保法を除いた法令に基づく研究発表は倫理審査委員会の審査は不要です.
- Q 19
- 既存のヒトの検体を使用した研究発表に関しては,同意書はすべての患者に必要ですか?
- A 19
- 匿名化されている(特定の個人を識別できない状態に加工され,対応表がどこにも存在しない)場合はインフォームド・コンセント:ICは不要です.
上記以外の場合であって,当該研究の目的と相当の関連性がある別研究等で既に同意を取得済みのものであれば,通知・公開のみで同意は不要です.それ以外の研究は,原則ICが必要ですが,オプトアウトでICに変えることが可能です.
上記何れの場合でも,新たに個人識別符号に該当するゲノムデータを取得する場合は,原則文書同意が必要となります.
- Q 20
- 培養細胞を用いた基礎的研究は倫理審査委員会の審査が必要ですか?
- A 20
- 一般に入手可能な細胞等を培養する研究は倫理審査委員会の審査は不要です.患者さんから得られた試料を用いて培養し研究する場合は,倫理審査委員会の審査が必要です.その場合,文書による同意が必要です.
- Q 21
- ヒト ES 細胞,ヒト iPS 細胞,ヒト組織幹細胞を利用した臨床研究は倫理審査以外に何が必要ですか?
- A 21
- 「再生医療等の安全性の確保等に関する法律(平成 25 年法律第 85 号)」を遵守する必要があります.
- Q 22
- 「ヒトゲノム・遺伝子解析研究に関する倫理指針」の対象となる研究とはどのようなものを指しますか?
- A 22
- 提供者の個体を形成する細胞に共通して存在し,その子孫に受け継がれ得るヒトゲノム・遺伝子の構造又はそれに由来する機能などを,試料・情報を用いて明らかにしようとする研究を指します.即ち,生殖細胞系列遺伝子変異やその多型性 (germline mutation or polymorphism)を解析する研究を指します.
- Q 23
- 倫理審査委員会を通さず発表した場合には,どんなペナルティが科せられますか?
- A 23
- JDDWとしては,演題発表者が常に倫理指針に則って真摯に行動されていることを前提にしています.倫理違反は,基本的に研究者及び施設の長が責任を負うことになります.違反の事実が判明した場合,各担当学会の審議対象になることがあります.
※なお,「人を対象とする医学系研究に関する倫理指針(文科省・厚労省)」では,以下の場合は重大な指針不適合となり,施設の長は厚生労働大臣(大学の場合は文部科学大臣にも)への報告が義務付けられています.
また,「特定臨床研究」に関して違反があった場合は,「臨床研究法」違反となり,研究責任者は処罰の対象となることがあります.① 倫理審査委員会の審査又は研究機関の長の許可を受けずに,研究を実施した場合 ② 必要なインフォームド・コンセントの手続を行わずに研究を実施した場合 ③ 研究内容の信頼性を損なう研究結果のねつ造や改ざんが発覚した場合
- Q 24
- 発表する際に,自分の研究が倫理指針上どのカテゴリーの研究に属するか,あるいは倫理審査を受けたかどうかを提示する必要はありますか? 利益相反(COI)のようなスライドを作成して提示する必要はありますか?
- A 24
- 現時点では Medical ethics をご提示頂く予定は有りません.但し,御自身の発表内容が倫理指針のどのカテゴリーに属するのかを充分理解した上でJDDWにおける発表に臨まれる事は“ヒトを対象とした医学系研究”を行う者として当然の基本姿勢であり,JDDWでの演題発表者に求められる基本ルールであることをご理解下さい.
※本Q&Aは,日本消化器外科学会作成のQ&Aを元に作成しています.
![Japan Digestive Disease Week 2019 [JDDW 2019 KOBE]|第27回 日本消化器関連学会週間](../images/title.png)